KHTN Lớp 7 Bài 6: Hóa trị, công thức hóa học Giải sách Khoa học tự nhiên lớp 7 Cánh diều trang 39
Giải KHTN 7 Bài 6 Cánh diều giúp các bạn học sinh lớp 7 có thêm nhiều gợi ý tham khảo để trả lời các câu hỏi nội dung bài học Hóa trị, công thức hóa học.
Soạn KHTN 7 Cánh diều Bài 6 được biên soạn với các lời giải chi tiết, đầy đủ và chính xác bám sát chương trình SGK. Hi vọng đây sẽ là tài liệu cực kì hữu ích hỗ trợ các em học sinh lớp 7 trong quá trình giải bài tập. Đồng thời phụ huynh có thể sử dụng để hướng dẫn con em học tập và đổi mới phương pháp giải phù hợp hơn. Vậy sau đây là Soạn Khoa học tự nhiên 7 Cánh diều Bài 6 Cánh diều mời các bạn theo dõi nhé.
Giải KHTN Lớp 7 Bài 6: Hóa trị, công thức hóa học
- Câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều
- Trả lời câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều
- Giải phần Luyện tập KHTN 7 Cánh diều Bài 6
Câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều
Cho các miếng bìa ghi kí hiệu hóa học của các nguyên tố C, O, Cl, H như hình dưới đây. Mỗi miếng bìa tượng trưng cho một nguyên tử. Hãy ghép các miếng bìa H với các miếng bìa khác sao cho phù hợp.
Hãy cho biết các nguyên tố C, O, Cl ghép được với tối đa bao nhiêu nguyên tử H. Dùng kí hiệu hóa học và các chữ số để mô tả trong những miếng ghép thu được có bao nhiêu nguyên tử của mỗi nguyên tố.
Trả lời:
Mỗi nguyên tử C có thể ghép tối đa với 4 nguyên tử H tạo thành hợp chất là CH4.
Mỗi nguyên tử O có thể ghép tối đa với 2 nguyên tử H tạo thành hợp chất là H2O
Mỗi nguyên tử Cl có thể ghép tối đa với 1 nguyên tử H tạo thành hợp chất HCl.
Trả lời câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều
Câu 1
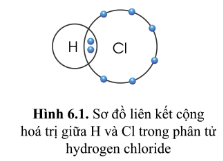
Hãy quan sát hình 6.1, hãy so sánh hoá trị của nguyên tố và số electron mà nguyên tử của nguyên tố đã góp chúng để tạo ra liên kết.
Gợi ý trả lời
Mỗi nguyên tử H và Cl giống nhau về hoá trị (chúng đều có hoá trị I ) và giống nhau về số electron góp chung để tạo ra liên kết ( mỗi nguyên tử H và Cl đều góp chung 1 electron để tạo ra liên kết trong phân tử )
Câu 2
Cát được sử dụng nhiều trong xây dựng và là nguyên liệu chính để sản xuất thủy tinh. Silicon oxide là thành phần chính của cát. Phân tử silicon oxide gồm 1 nguyên tử Si liên kết với 2 nguyên tử O. Dựa vào hóa trị của các nguyên tố trong bảng 6.1, hãy tính tích hóa trị và số nguyên tử của mỗi nguyên tố trong phân tử silicon oxide. Nhận xét về tích đó.
Gợi ý trả lời
| Nguyên tố | Si | O |
| Hóa trị | IV | II |
| Số nguyên tử | 1 | 2 |
| Tích hóa trị và số nguyên tử | IV × 1 = II × 2 | |
Nhận xét: Tích giữa hoá trị và số nguyên tử của nguyên nguyên tố Si bằng với tích giữa hoá trị và số nguyên tử của nguyên nguyên tố O
Câu 3
Cho công thức hóa học của một số chất như sau:
a) N2 (nitrogen)
b) NaCl (sodium chloride)
c) MgSO4 (magnesium sulfate)
Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử.
Gợi ý trả lời
a) N2 (nitrogen):
+ N2 được tạo thành từ nguyên tố N.
+ Phân tử N2 có 2 nguyên tử N.
b) NaCl (sodium chloride):
+ NaCl được tạo thành từ hai nguyên tố là Na và Cl.
+ Trong phân tử NaCl có 1 nguyên tử Na và 1 nguyên tử Cl.
c) MgSO4 (magnesium sulfate):
+ MgSO4được tạo thành từ 3 nguyên tố là Mg, S và O.
+ Trong phân tử MgSO4 có 1 nguyên tử Mg, 1 nguyên tử S và 4 nguyên tử O.
Câu 4
Có ý kiến cho rằng: Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O. Theo em, ý kiến trên có đúng không? Hãy tính phần trăm khối lượng của H, O trong nước để chứng minh.
Gợi ý trả lời
Tính phần trăm khối lượng của H, O trong H2O
Ta có:
Khối lượng của nguyên tố H trong H2O là:
mH = 2 × 1 = 2 (amu)
Khối lượng của nguyên tố O trong H2O là:
mO = 1 × 16 = 16 (amu)
→ Khối lượng phân tử H2O là: 2 + 16 = 18 (amu)
Phần trăm về khối lượng của H trong H2O là:
![]() \(\%m_H=\frac{m_H}{mH_2O}\times\;100\%=\;\frac{\;2}{18}\;\times100\%\;=11,11\%\)
\(\%m_H=\frac{m_H}{mH_2O}\times\;100\%=\;\frac{\;2}{18}\;\times100\%\;=11,11\%\)
Phần trăm về khối lượng của O trong H2O là:
![]() \(\%m_O=\frac{m_O}{mH_2O}\times\;100\%=\;\frac{\;16}{18}\;\times100\%\;=88,89\%\)
\(\%m_O=\frac{m_O}{mH_2O}\times\;100\%=\;\frac{\;16}{18}\;\times100\%\;=88,89\%\)
Vậy ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không chính xác.
Giải phần Luyện tập KHTN 7 Cánh diều Bài 6
Luyện tập 1
Quan sát hình 6.3 và xác định hóa trị của C và O trong khí carbonic

Gợi ý đáp án
Quan sát hình 6.3 ta thấy:
Nguyên tử O góp chung 2 electron
Nguyên tử C góp chung 4 electron
=> Nguyên tử C liên kết với 2 nguyên tử O bằng 4 cặp đôi electron
chung => C có hóa trị IV và O có hóa trị II.
Luyện tập 2
Vẽ sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H. Hãy cho biết liên kết đó thuộc loại liên kết nào. Hóa trị của mỗi nguyên tố trong hợp chất được tạo thành là bao nhiêu?
Gợi ý đáp án
+ Sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H:
+ Liên kết giữa N và H được tạo thành bởi đôi electron dùng chung giữa hai nguyên tử
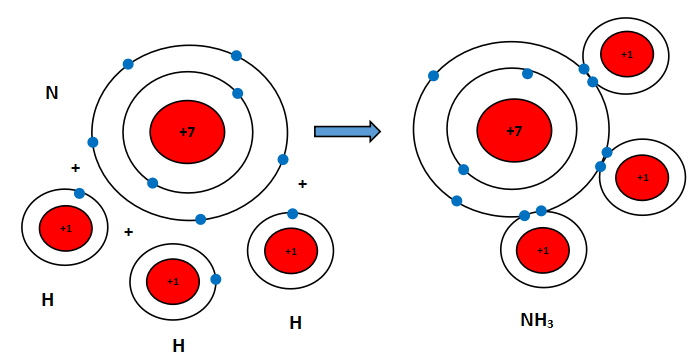
⇒ là liên kết cộng hóa trị.
+ Nguyên tử N góp 3 electron ⇒ N có hóa trị III.
+ Nguyên tử H góp chung 1 electron ⇒ H có hóa trị I.
Luyện tập 3
Dựa vào hóa trị của các nguyên tố trong bảng 6.1 và quy tắc hóa trị, hãy cho biết mỗi nguyên tử Mg có thể kết hợp được với bao nhiêu nguyên tử Cl.
Gợi ý đáp án
| Nguyên tố | Mg | Cl |
| Hóa trị | II | I |
| Số nguyên tử | 1 | y |
| Tích hóa trị và số nguyên tử | II × 1 = I × y | |
Từ tích hóa trị và số nguyên tử ta có: II × 1 = I × y ⇒ y = 2
Vậy mỗi nguyên tử Mg có thể kết hợp được với 2 nguyên tử Cl
Luyện tập 4
Nguyên tố A có hóa trị III, nguyên tố B có hóa trị II. Hãy tính tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ 2 nguyên tố đó.
Gợi ý đáp án
| Nguyên tố | A | B |
| Hóa trị | III | II |
| Số nguyên tử | x | y |
| Tích hóa trị và số nguyên tử | III × x = II × y | |
Ta có: III × x = II × y
![]() \(\Rightarrow\frac xy=\frac{II}{III}=\frac23\)
\(\Rightarrow\frac xy=\frac{II}{III}=\frac23\)
Vậy tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó là 2:3
Luyện tập 5
Viết công thức hóa học của các chất:
a) Sodium sulfide, biết trong phân tử có hai nguyên tử Na và một nguyên tử S.
b) Phosphoric acid, biết trong phân tử có ba nguyên tử H, một nguyên tử P và bốn nguyên tử O.
Gợi ý đáp án
a) Sodium sulfide: Na2S
b) Phosphoric acid: H3PO4
Luyện tập 6
Viết công thức hóa học cho các chất được biểu diễn bằng những mô hình sau. Biết mỗi quả cầu biểu diễn cho 1 nguyên tử
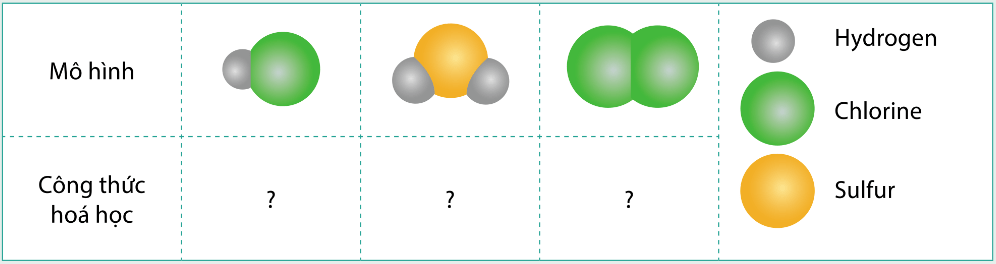
Gợi ý đáp án
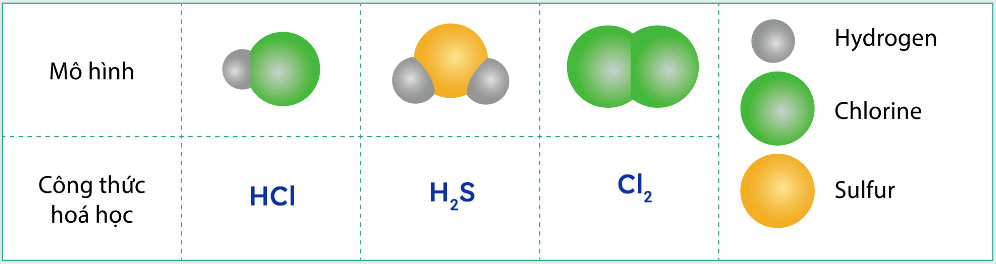
Luyện tập 7
Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hóa học là C6H12O6. Hãy cho biết:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong 1 phân tử glucose là bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Gợi ý đáp án
a) Glucose được tạo thành từ ba nguyên tố đó là C, H, O.
b) Trong một phân tử glucose có 6 nguyên tử C, 12 nguyên tử H, 6 nguyên tử O.
Trong một phân tử glucose:
Khối lượng C: 6 × 12 = 72 amu
Khối lương H: 12 × 1 = 12 amu
Khối lượng O: 6 × 16 = 96 amu
c) Khối lượng phân tử của glucose là: 72 + 12 + 96 = 180 amu.
Luyện tập 8
Calcium carbonate là thành phần chính của đá vôi, có công thức hóa học là CaCO3. Tính phần trăm khối lượng của mỗi nguyên tố trong hợp chất trên.
Gợi ý đáp án
Tính phần trăm khối lượng của Ca, C, O trong CaCO3
Khối lượng của nguyên tố Ca trong CaCO3 là:
1 × 40 = 40 (amu)
Khối lượng của nguyên tố C trong CaCO3 là:
1 × 12 = 12 (amu)
Khối lượng của nguyên tố O trong CaCO3 là:
3 × 16 = 48 (amu)
→ Khối lượng phân tử CaCO3 là: = 40 + 12 + 48 = 100 amu
Phần trăm về khối lượng của Ca trong CaCO3 là:
![]() \(\%m_{Ca\;}=\frac{\;m_{Ca}}{M_{CaCO_3}}\times100\%=\frac{40}{100}\times100\%=40\%\)
\(\%m_{Ca\;}=\frac{\;m_{Ca}}{M_{CaCO_3}}\times100\%=\frac{40}{100}\times100\%=40\%\)
Phần trăm về khối lượng của C trong CaCO3 là:
![]() \(\%m_{C\;}=\frac{\;m_C}{M_{CaCO_3}}\times100\%=\frac{12}{100}\times100\%=12\%\)
\(\%m_{C\;}=\frac{\;m_C}{M_{CaCO_3}}\times100\%=\frac{12}{100}\times100\%=12\%\)
Phần trăm về khối lượng của O trong CaCO3 là:
100% - 40% - 12% = 48%
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Chủ đề liên quan
Có thể bạn quan tâm
-

Văn mẫu lớp 8: Cảm nhận về cái kết của truyện Cô bé bán diêm
-

Văn mẫu lớp 12: Phân tích 9 câu đầu bài Đất Nước của Nguyễn Khoa Điềm
-

Bài thu hoạch cá nhân về kết quả học tập, quán triệt Nghị quyết XII
-

Văn mẫu lớp 12: Nghị luận về nỗi sợ hãi của con người (Dàn ý + 8 mẫu)
-

Dàn ý 8 câu đầu bài Tình cảnh lẻ loi của người chinh phụ (5 mẫu)
-

Bộ đề thi học kì 2 môn Khoa học tự nhiên 8 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Văn mẫu lớp 12: Nghị luận về ý kiến Chi tiết nhỏ làm nên nhà văn lớn (Dàn ý + 4 mẫu)
-

Đoạn văn tiếng Anh viết về lợi ích của việc học Đại học
-

Công thức tính đường cao trong tam giác
-

Bài thu hoạch thăng hạng giáo viên Mầm non hạng II (3 mẫu)
Mới nhất trong tuần
-

Viết đoạn văn ngắn về phong trào trồng và bảo vệ cây xanh ở địa phương
10.000+ 1 -

So sánh sinh sản vô tính và sinh sản hữu tính
100.000+ 2 -

Bộ đề thi học sinh giỏi môn Khoa học tự nhiên 7 - Cấp trường
5.000+ -

Vẽ tranh tuyên truyền về ảnh hưởng của tốc độ trong an toàn giao thông
5.000+ -
KHTN Lớp 7 Bài 23: Trao đổi khí ở sinh vật
1.000+ -

KHTN Lớp 7: Bài tập Chủ đề 4
5.000+ -

Phân biệt trao đổi khí ở động vật và thực vật
1.000+ -

KHTN Lớp 7 Bài 1: Nguyên tử
5.000+ -

KHTN Lớp 7 Bài mở đầu: Phương pháp và kĩ năng trong học tập môn khoa học tự nhiên
1.000+ -
KHTN Lớp 7: Bài tập Chủ đề 8
10.000+






 Toán 7 Kết nối tri thức
Toán 7 Kết nối tri thức
 Toán 7 Chân trời sáng tạo
Toán 7 Chân trời sáng tạo
 Toán 7 Cánh Diều
Toán 7 Cánh Diều
 Soạn Văn 7 Chân trời sáng tạo
Soạn Văn 7 Chân trời sáng tạo
 Soạn Văn 7 Cánh Diều
Soạn Văn 7 Cánh Diều
 Soạn Văn 7 Kết nối tri thức
Soạn Văn 7 Kết nối tri thức
 Tiếng Anh 7 Global Success
Tiếng Anh 7 Global Success
 Tiếng Anh 7 Explore English
Tiếng Anh 7 Explore English
 Tiếng Anh 7 - iLearn Smart World
Tiếng Anh 7 - iLearn Smart World