Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals Giải Hoá học lớp 10 trang 64 sách Cánh diều
Giải Hóa 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Cánh diều trang 64, 65, 66, 67, 68 69.
Hóa 10 bài 12: Liên kết hydrogen và tương tác Van Der Waals được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 bài 12 trang 64→69 sách Cánh diều, mời các bạn cùng theo dõi tại đây.
Giải Hóa 10: Liên kết hydrogen và tương tác Van Der Waals
Lý thuyết Liên kết hydrogen và tương tác Van Der Waals
1. Bản chất của liên kết hydrogen
- Bản chất: Nguyên tử hydrogen trong phân tử HF, H2O, NH3 rất linh động, có điện tích dương đủ lớn để hút cặp electron hóa trị chưa liên kết trên nguyên tử F, O hoặc N (của phân tử khác) có độ âm điện lớn tạo thành liên kết hydrogen
2. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước
3. Tương tác Van Der Waals
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử
- Bản chất:
- Trong phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời:
- Các phân tử có lưỡng cực tạm thời cũng có thể làm các phân tử lân cận xuất hiện các lưỡng cực cảm ứng. Do đó, các phân tử có thể tập hợp thành một mạng lưới với tương tác lưỡng cực cảm ứng, được gọi là tương tác van der Waals
Giải bài tập Hóa 10 Bài 12 trang 69
Bài 1
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. CH4
B. NH3
C. H3C-O-CH3
D. PH3
Gợi ý đáp án
Đáp án B
Bài 2
Nhiệt nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:
| Chất | Nhiệt độ nóng chảy (oC) | Nhiệt độ sôi (oC) |
| ? | –86,9 | –66,8 |
| ? | – 83,6 | 19,5 |
Gợi ý đáp án
| Chất | Nhiệt độ nóng chảy (oC) | Nhiệt độ sôi (oC) |
| HBr | –86,9 | –66,8 |
| HF | – 83,6 | 19,5 |
Độ âm điện của F lớn hơn Br nên tương tác hút tĩnh điện giữa Hδ+ và Fδ- lớn hơn tương tác hút tĩnh điện giữa Hδ+ và Brδ-.
⇒ Các phân tử HF liên kết chặt chẽ với nhau bởi các liên kết hydrogen hơn so với các phân tử HBr.
⇒ Nhiệt độ nóng chảy và nhiệt độ sôi của HF lớn hơn so với HBr.
Bài 3
Chọn phương án đúng
1. Những phát biểu nào sau đây là đúng khi nói về các loại liên kết?
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Gợi ý đáp án
Những phát biểu đúng là:
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
Bài 4
Các liên kết biểu diễn bằng các đường nét đứt được minh họa như hình dưới đây có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion
B. Liên kết cộng hóa trị có cực
C. Liên kết cộng hóa trị không cực
D. Liên kết hydrogen
Gợi ý đáp án
Liên kết biểu diễn bằng các đường nét đứt là liên kết hydrogen.
Bài 5
Một kết quả nghiên cứu mới đây cho thấy các phân tử NH 3 có thể liên kết với nhau thành những cụm (NH 3 ) n với n = 3 – 6. (Theo ACS Omega 2020, 5, 49, 31724-31729).
Vì sao các phân tử NH 3 có thể hình thành được cụm phân tử này?
Gợi ý đáp án
Trong phân tử NH3 có nguyên tử H liên kết với nguyên tử N (có độ âm điện mạnh) còn cặp electron riêng.
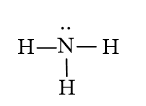
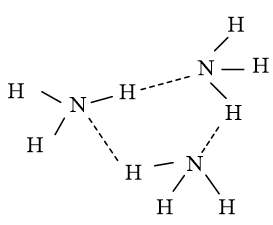
Do đó các phân tử NH3 có thể liên kết với nhau bằng liên kết hydrogen tạo thành những cụm phân tử.
Cụm phân tử (NH3)3
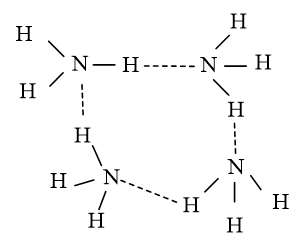
Cụm phân tử (NH3)4
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Chủ đề liên quan
Có thể bạn quan tâm
-

Bài phát biểu tổng kết công tác hội phụ nữ năm 2022
-

Giới thiệu về bản thân bằng tiếng Anh lớp 10 (Cách viết + 10 Mẫu)
-
Văn mẫu lớp 8: Phân tích nhân vật Đôn Ki-hô-tê trong truyện Đánh nhau với cối xay gió
-

Bộ đề thi học kì 2 môn Giáo dục công dân 7 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Bộ đề thi học kì 2 môn Toán 5 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Văn mẫu lớp 7: Đoạn văn cảm nhận tình cảnh của người nông dân trong Sống chết mặc bay
-

Kể lại buổi lễ kỉ niệm ngày Nhà giáo Việt Nam (2 Dàn ý + 10 mẫu)
-

Văn mẫu lớp 8: Cảm nhận về cái kết của truyện Cô bé bán diêm
-

Văn mẫu lớp 12: Phân tích 9 câu đầu bài Đất Nước của Nguyễn Khoa Điềm
-

Bài thu hoạch cá nhân về kết quả học tập, quán triệt Nghị quyết XII
Mới nhất trong tuần
-
Hóa học 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1.000+ -

Phiếu học tập môn Hóa học 10 sách Cánh diều
100+ -

Hoá học 10 Bài 2: Thành phần của nguyên tử
1.000+ 1 -
Hoá học 10 Bài 1: Nhập môn hóa học
100+ -

Hóa học 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
100+ -
Hóa học 10 Bài 13: Phản ứng oxi hóa – khử
100+ -

Hóa học 10 Bài 14: Phản ứng hóa học và enthalpy
100+ -

Hóa học 10 Bài 16: Tốc độ phản ứng hóa học
100+ -

Hóa học 10 Bài 17: Nguyên tố và đơn chất Halogen
100+ -

Hóa học 10 Bài 18: Hydrogen halide và hydrohalic acid
100+






 Toán 10 Kết nối tri thức
Toán 10 Kết nối tri thức
 Toán 10 Chân trời sáng tạo
Toán 10 Chân trời sáng tạo
 Toán 10 Cánh Diều
Toán 10 Cánh Diều
 Soạn văn 10 Chân trời sáng tạo
Soạn văn 10 Chân trời sáng tạo
 Soạn văn 10 Cánh Diều
Soạn văn 10 Cánh Diều
 Soạn văn 10 Kết nối tri thức
Soạn văn 10 Kết nối tri thức
 Tiếng Anh 10 Global Success
Tiếng Anh 10 Global Success
 Tiếng anh 10 Friends Global
Tiếng anh 10 Friends Global
 Tiếng Anh 10 Explore New Worlds
Tiếng Anh 10 Explore New Worlds