Hóa 12 Bài 13: Điện phân Giải Hóa 12 Chân trời sáng tạo trang 70, 71, 72, 73, 74
Giải bài tập SGK Hóa học 12 trang 70, 71, 72, 73, 74 sách Chân trời sáng tạo giúp các em học sinh lớp 12 xem gợi ý giải các câu hỏi Bài 13: Điện phân thuộc Chương 5: Pin điện và điện phân.
Soạn Hóa 12 Chân trời sáng tạo Bài 13 các em sẽ biết cách trả lời toàn bộ các câu hỏi bài học này. Đồng thời, qua tài liệu này giúp quý thầy cô tham khảo để soạn giáo án cho học sinh của mình theo chương trình mới. Mời thầy cô và các em cùng theo dõi bài viết dưới đây của Eballsviet.com:
Giải Hóa 12 Bài 13: Điện phân
Giải Hóa 12 Chân trời sáng tạo Bài 13 - Luyện tập
Luyện tập trang 70
Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3.
Lời giải:
Phương trình hoá học:

Luyện tập trang 72
Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch AgNO3; CuCl2 với điện cực graphite.
Lời giải:
* Điện phân dung dịch AgNO3:
Tại anode (cực dương): 2H2O → O2 + 4H+ + 4e
Tại cathode (cực âm): Ag+ + 1e → Ag
Phương trình hoá học của phản ứng điện phân:

* Điện phân dung dịch CuCl2:
Tại anode (cực dương): 2Cl− → Cl2 + 2e
Tại cathode (cực âm): Cu2+ + 2e → Cu
Phương trình hoá học của phản ứng điện phân:

Giải Hóa 12 Chân trời sáng tạo Bài 13 - Bài tập
Bài tập 1
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+.
B. Khử ion Ca2+.
C. Oxi hoá ion Cl−.
D. Khử ion Cl−.
Lời giải:
Đáp án đúng là: B
Bài tập 2
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, ở anode xảy ra quá trình nào?

Lời giải:
Đáp án đúng là: A
Bài tập 3
Viết phương trình hoá học của phản ứng điện phân khi điện phân KCl nóng chảy.
Lời giải:
Phương trình hoá học:
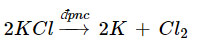
Bài tập 4
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.
Lời giải:
Mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân với anode làm bằng đồng và cathode là vật bằng sắt cần được mạ và cùng được nhúng trong dung dịch Cu2+ (dung dịch muối của đồng, ví dụ CuSO4).
- Ở anode: Cu → Cu2+ + 2e (điện cực đồng tan ra).
- Ở cathode: Cu2+ + 2e → Cu (đồng sinh ra bám vào vật cần mạ).
Hai quá trình này giữ cho nồng độ CuSO4 trong bình điện phân không đổi.
Chọn file cần tải:
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Chủ đề liên quan
Có thể bạn quan tâm
-

Bộ đề thi học kì 2 môn Ngữ văn 8 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Đáp án cuộc thi Giao lưu tìm hiểu An toàn giao thông cho giáo viên năm 2022 - 2023
-

Văn mẫu lớp 12: Nghị luận xã hội về sự thành công trong cuộc sống
-

Văn mẫu lớp 12: Nghị luận xã hội cách nuôi dưỡng vẻ đẹp tâm hồn
-

Soạn bài Tự đánh giá: Gói thuốc lá Cánh diều
-

Đề cương ôn tập học kì 2 môn Lịch sử - Địa lí lớp 5 năm 2024 - 2025 (Sách mới)
-

Bộ đề thi học kì 2 môn Hoạt động trải nghiệm hướng nghiệp 7 sách Kết nối tri thức với cuộc sống
-

Bài thu hoạch bồi dưỡng kiến thức quốc phòng an ninh đối tượng 3
-

Thuyết minh về trò chơi dân gian ô ăn quan (Dàn ý + 12 mẫu)
-

Viết bài luận về bản thân để tham gia câu lạc bộ tình nguyện
Mới nhất trong tuần
-

Hóa 12 Bài 13: Điện phân
100+ -

Hóa 12 Bài 12: Thế điện cực và nguồn điện hoá học
100+ -

Hóa 12 Bài 11: Tơ - Cao su - Keo dán tổng hợp
100+ -

Hóa 12 Bài 10: Chất dẻo và vật liệu composite
10.000+ -

Hóa 12 Bài 9: Đại cương về polymer
100+ -

Hóa 12 Bài 8: Protein và enzyme
100+ -
Hóa 12 Bài 7: Amino acid và peptide
100+ -
Hóa 12 Bài 6: Amine
100+ -

Hóa 12 Bài 5: Tinh bột và cellulose
100+ -
Hóa 12 Bài 4: Saccharose và maltose
1.000+







 Đề thi học kì 1 Lớp 12
Đề thi học kì 1 Lớp 12
 Đề thi giữa học kì 1 Lớp 12
Đề thi giữa học kì 1 Lớp 12
 Đề thi giữa học kì 2 Lớp 12
Đề thi giữa học kì 2 Lớp 12
 Đề thi học kì 2 Lớp 12
Đề thi học kì 2 Lớp 12
 Soạn Văn 12 KNTT
Soạn Văn 12 KNTT
 Soạn Văn 12 CTST
Soạn Văn 12 CTST
 Soạn Văn 12 Cánh Diều
Soạn Văn 12 Cánh Diều
 Văn 12
Văn 12
 Toán 12 Chân trời sáng tạo
Toán 12 Chân trời sáng tạo