Hóa học 10 Bài 8: Quy tắc Octet Giải Hoá học lớp 10 trang 52 sách Chân trời sáng tạo
Giải Hóa 10 Bài 8: Quy tắc Octet sách Chân trời sáng tạo là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách giáo khoa trang 52→ 54 thuộc chương 3: Liên kết hóa học.
Hóa 10 bài 8 Quy tắc Octet được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 bài 8 trang 52 sách Chân trời sáng tạo, mời các bạn cùng theo dõi tại đây.
Bài 1
Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
| A. Fluorine | B. Oxygen | C. Hydrogen | D. Chlorine |
Gợi ý đáp án
Đáp án D
Fluorine (Z = 9): 1s22s22p5
⇒ Có 7 electron lớp ngoài cùng. Có xu hướng nhận 1 electron thành F- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
Oxygen (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron thành O2- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
Hydrogen (Z = 1): 1s1⇒ Có xu hướng góp chung 1 electron để tạo thành 1 cặp electron dùng chung đạt cấu hình: 1s2 giống với cấu hình khí hiếm He.
Chlorine (Z = 17): 1s22s22p63s23p5⇒ Có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Vậy nguyên tử của nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon
Bài 2
Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
| A. 2 electron | B. 3 electron | C. 1 electron | D. 4 electron |
Gợi ý đáp án
Đáp án C
Nguyên tử potassium có Z = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6
Bài 3
Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium
Gợi ý đáp án
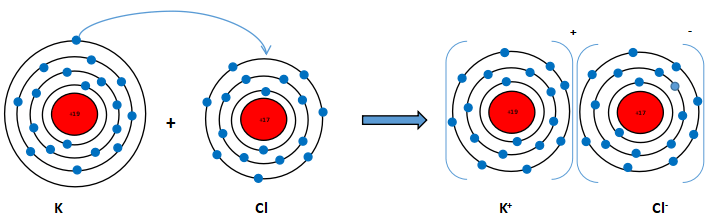
Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 ⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+
Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 ⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
Sơ đồ mô tả:
Bài 4
Giải thích sự hình thành liên kết trong phân tử H2O bằng cách áp dụng quy tắc
Gợi ý đáp án
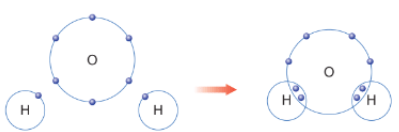
Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
Nguyên tử H (Z = 1): 1s1 ⇒ Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
Chọn file cần tải:
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Chủ đề liên quan
Có thể bạn quan tâm
-

Bộ đề thi học kì 2 môn Toán 5 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Văn mẫu lớp 7: Đoạn văn cảm nhận tình cảnh của người nông dân trong Sống chết mặc bay
-

Kể lại buổi lễ kỉ niệm ngày Nhà giáo Việt Nam (2 Dàn ý + 10 mẫu)
-

Văn mẫu lớp 8: Cảm nhận về cái kết của truyện Cô bé bán diêm
-

Văn mẫu lớp 12: Phân tích 9 câu đầu bài Đất Nước của Nguyễn Khoa Điềm
-

Bài thu hoạch cá nhân về kết quả học tập, quán triệt Nghị quyết XII
-

Văn mẫu lớp 12: Nghị luận về nỗi sợ hãi của con người (Dàn ý + 8 mẫu)
-

Dàn ý 8 câu đầu bài Tình cảnh lẻ loi của người chinh phụ (5 mẫu)
-

Bộ đề thi học kì 2 môn Khoa học tự nhiên 8 năm 2024 - 2025 sách Kết nối tri thức với cuộc sống
-

Văn mẫu lớp 12: Nghị luận về ý kiến Chi tiết nhỏ làm nên nhà văn lớn (Dàn ý + 4 mẫu)
Mới nhất trong tuần
-

Hoá học 10 Bài 1: Nhập môn Hóa học
1.000+ -

Hoá học 10 Bài 2: Thành phần của nguyên tử
1.000+ -

Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
100+ -

Hóa học 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
100+ -

Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
100+ -

Hóa học 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
100+ -

Hóa học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
100+ -

Hóa học 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
100+ -

Hóa học 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
100+ -
Quy tắc bát tử: nội dung của quy tắc bát tử
1.000+






 Toán 10 Kết nối tri thức
Toán 10 Kết nối tri thức
 Toán 10 Chân trời sáng tạo
Toán 10 Chân trời sáng tạo
 Toán 10 Cánh Diều
Toán 10 Cánh Diều
 Soạn văn 10 Chân trời sáng tạo
Soạn văn 10 Chân trời sáng tạo
 Soạn văn 10 Cánh Diều
Soạn văn 10 Cánh Diều
 Soạn văn 10 Kết nối tri thức
Soạn văn 10 Kết nối tri thức
 Tiếng Anh 10 Global Success
Tiếng Anh 10 Global Success
 Tiếng anh 10 Friends Global
Tiếng anh 10 Friends Global
 Tiếng Anh 10 Explore New Worlds
Tiếng Anh 10 Explore New Worlds